1编号:97944题型:解答题测试正确率:0%
过氧化钠(Na2O2)可用在呼吸面具中作为氧气来源。Na2O2能跟CO2反应生成O2和另一种固体化合物(用X表示);它也能跟H2O反应生成O2,化学方程式为2Na2O2+2H2O![]() 4NaOH+O2↑。以下是某兴趣小组进行的探究活动。
4NaOH+O2↑。以下是某兴趣小组进行的探究活动。
(1)利用如下图所示实验装置制取氧气,请回答有关问题。

①实验室制取CO2的化学方程式为 。
②表明CO2未被Na2O2完全吸收的实验现象为 。
③O2可采用D装置收集,并用带火星的木条检验,这是利用了O2的哪些性质?
④若A装置产生的CO2中混有水蒸气,要检验干燥的CO2能否与Na2O2反应生成O2,以上实验装置应如何改进?
(2)为探究X是哪种物质及其有关性质,同学们进行了如下分析和实验。
①有同学猜想X可能是酸、碱或盐中的一种。通过对物质组成的分析,大家一致认为X肯定不是酸和碱,理由是 。
②同学们通过讨论和实验证明了X是Na2CO3。以下是他们设计的有关Na2CO3的性质探究实验,根据你所学的知识,将下表填写完整。

(3)7.8 g过氧化钠与足量的水反应,生成氧气的质量是多少?若反应后得到了40 g氢氧化钠溶液,请计算氢氧化钠溶液中溶质的质量分数。
2编号:97542题型:解答题测试正确率:0%
金属材料在生产生活中有重要的作用。
(1)铁制品在一定条件下会生锈,疏松的铁锈不能阻止里层的铁继续与 反应,因此铁制品可以进一步锈蚀。防止自行车链条生锈的合理措施是 。回收利用废旧金属制品的目的之一是 。
(2)某同学为了验证Fe、Zn、Cu三种金属的活动性顺序,设计了如下实验:
A.将锌片浸入稀硫酸溶液中;
B.将铜片浸入稀硫酸溶液中;
C.将锌片浸入硫酸亚铁溶液中。
该组实验能否完全证明三种金属的活动性顺序?若能,说明理由;若不能,请你补充一个实验达到目的。
(3)在Cu(NO3)2和Al(NO3)3的混合溶液中加入一定量的锌粉,充分反应后过滤。向滤出的固体上滴加稀硫酸时有气泡产生,则反应后所得溶液中含有的金属离子有 (用离子符号表示)。
(4)工业上炼铁的原理是利用一氧化碳和氧化铁反应,某兴趣小组利用如图装置进行实验,请按要求回答:
①CO还原Fe2O3的化学方程式为 ;
②如果A装置中红棕色固体变成黑色,则B试管中观察的现象为
,右边导气管口放置点燃的酒精灯的目的是 。

(5)用含杂质的铁10g(杂质不溶于水,也不参加反应)与100g稀硫酸恰好完全反应,滤去杂质,得到滤液的质量为108.1g,计算该含杂质的铁中铁的质量分数。
3编号:95495题型:解答题测试正确率:0%
烧碱(NaOH)是一种重要的化工原料,广泛用于制肥皂、造纸等工业。请回答下列有关问题。
(1)在工业上通常用电解饱和NaCl溶液的方法制取烧碱,产物除烧碱外,还有H2和Cl2,请写出有关反应的化学方程式。
(2)烧碱放置在空气中会变质,请设计一个实验,在检验氢氧化钠变质的同时又能除去杂质(用化学方程式来表示)。
(3)在烧碱溶液和稀盐酸进行中和反应实验时,一般需要在烧碱溶液中滴加酚酞溶液,酚酞溶液的作用是什么?最后得到的溶液中溶质的构成微粒是 。
(4)下图是某同学用氢氧化钠固体和水配制50 g 5%的NaOH溶液的部分操作过程,该同学在称量氢氧化钠时,先在两个托盘上各放上一张质量相同的纸,然后把药品直接放在纸上称量。
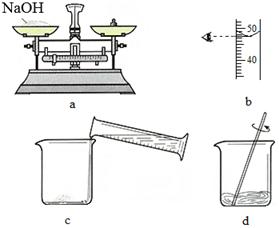
①a操作中有错误,正确的操作是 。
②下列操作中,会导致所配溶液中溶质的质量分数偏低的有 (填字母代号)。
A.a操作中将砝码放在左盘(1 g以下用游码)
B.b操作中平视量筒凹液面最低处读数为47.5 mL
C.c操作中烧杯用水洗涤后未干燥就使用
D.d操作中有少量溶液溅出(假设已搅拌均匀)
(5)73 g质量分数为20%的盐酸与一定质量的氢氧化钠溶液恰好完全反应,生成的氯化钠溶液中溶质的质量分数为13.52%。请计算氯化钠溶液的质量。
4编号:95494题型:解答题测试正确率:0%
钠及其化合物是中学化学学习和研究的重要内容。
(1)下图是钠的原子结构示意图。下列说法不正确的是 。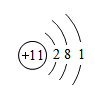
a.钠属于金属元素
b.钠原子的质子数为11
c.钠离子的符号为Na+
d.钠在化学反应中易得到电子
(2)钠与水反应生成氢氧化钠和氢气,化学方程式为 ;
小苏打受热分解生成碳酸钠、二氧化碳和水,化学方程式为 。
(3)配制一瓶下图溶液需氯化钠 g;配制50 g 6%的氯化钠溶液,若用量
筒量取水时俯视读数(其他操作正确),则溶液的质量分数 6%(填“![]() ”、
”、
“![]() ”或“
”或“![]() ”)。
”)。
(4)已知:2Na2O2+2H2O![]() 4NaOH+O2↑;2Na2O2+2CO2
4NaOH+O2↑;2Na2O2+2CO2![]() 2Na2CO3+O2↑。
2Na2CO3+O2↑。
实验室敞口放置的过氧化钠(Na2O2)已部分变质,取少量该固体样品于试管中,
加足量水,可观察到什么现象?如何检验该水溶液中含有的氢氧化钠?(请简要
写出实验步骤和现象)
(5)钛和钛合金性能优良,广泛用于航空、造船和化学工业中。工业上常用钠
来制取钛,在高温时,钠与四氯化钛(TiCl4)反应生成氯化钠和钛。若要用该
方法制取2.4 kg钛,理论上需要钠的质量是多少?(Ti的相对原子质量为48)
5编号:95493题型:解答题测试正确率:0%
某校研究性小组用如图所示装置进行镁条在空气中燃烧的实验。待镁条燃烧完全并冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶容积的70%。

(1)图中A仪器的名称是 。镁条燃烧并冷却后打开止水夹,水能进入到集气瓶中的原因是 。
(2)如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的 %。现进入集气瓶中水的体积约为其容积的70%,根据空气的组成可推出减少的气体中有氮气。
发现问题】氮气是如何减少的?
【做出猜想】 。
【查阅资料】镁条在氮气中能燃烧,产物为氮化镁(Mg3N2)固体。氮化镁中氮的化合价是 。镁条还可以在二氧化碳气体中燃烧生成碳和氧化镁,反应的化学方程式为2Mg+CO2![]() C+2MgO,该反应所属的基本反应类型是 。
C+2MgO,该反应所属的基本反应类型是 。
(3)通过以上探究,你对燃烧的有关知识有了哪些新的认识?(写出一条即可)
(4)24 g镁在二氧化碳中燃烧可生成多少克氧化镁?
6编号:95492题型:解答题测试正确率:0%
郑州地铁极大缓解了市内交通的压力,同时也改善了空气质量。
(1)地铁站里氧气含量的测定:取一瓶从地铁站里收集的空气,利用下图实验
装置测定样品中氧气的含量。请指出测定时需要注意的事项(写出3条即可)。
(2)金属材料在地铁方面的应用:
①地铁入口处的雨篷骨架用铝合金而不用纯铁的原因是 。
②钢轨用锰钢的原因是 。
③出口处的广告架是金属经焊接而成的,焊条的熔点 (填“![]() ”“
”“![]() ”或“
”或“![]() ”)组成焊条的纯金属的熔点。
”)组成焊条的纯金属的熔点。
(3)金属的活动性:为了探究铜、锌、铁的活动性,把等表面积的铁片和锌片
放入硫酸铜溶液中(如下图)。
①如何判断它们是否发生了化学反应?
②反应后,其中一个试管的溶液质量会增加,请写出该试管中发生反应的化学方程式。
③上述实验不能完全证明三种金属的活动性,需补做的实验是 。
(4)郑州地铁1号线每车次运送乘客约为1800人,走同样的路线,CNG公交车每车次消耗天然气a kg(以甲烷计算),每辆CNG公交车运送乘客以60名计。若乘CNG公交车的乘客均改乘地铁1号线,则地铁每运行一车次,可以减少排放二氧化碳的质量是多少?
7编号:73537题型:解答题测试正确率:0%
金属材料在生产生活中有重要的作用。
(1)铁制品在一定条件下能生锈,疏松的铁锈不能阻碍里层的铁继续与 反应,因此铁制品可以进一步锈蚀。防止自行车链条生锈的合理措施是 。回收利用废旧金属制品的目的之一是 。
(2)某同学为了验证Fe、Zn、Cu三种金属的活动性顺序,设计了如下实验:
A.将锌片浸入稀硫酸溶液中;
B.将铜片浸入稀硫酸溶液中;
C.将锌片浸入硫酸亚铁溶液中。
该组实验能否完全证明三种金属的活动性顺序?若能,说明理由;若不能,请你补充一个实验达到目的。
(3)在Cu(NO3)2和Al(NO3)3的混合溶液中加入一定量的锌粉,充分反应后过滤。向滤出的固体上滴加稀硫酸时有气泡产生,则反应后所得溶液中含有的金属离子有 (用离子符号表示)。
(4)工业上炼铁的原理是利用一氧化碳和氧化铁反应,某兴趣小组利用如图装置进行实验,请按要求回答:
①CO还原Fe2O3的化学方程式为 ;
②如果A装置中红棕色固体变成黑色,则B试管中观察的现象为 ,右边导气管口放置点燃的酒精灯的目的是 。
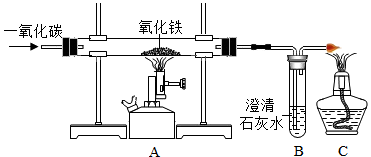
(5)用含杂质的铁10g(杂质不溶于水,也不参加反应)与100g稀硫酸恰好完全反应,滤去杂质,得到滤液质量为108.1g,则含杂质的铁中铁的质量分数。
8编号:73535题型:解答题测试正确率:0%
我国拥有丰富的海洋资源,综合利用这些宝贵的资源有力地促进了我国经济的发展。
(1)从海水中提取出的粗盐中除了NaCl外,还含有泥沙等杂质。请完善下列实验室中除去泥沙等杂质的实验步骤,并回答相关问题:
![]()
其中操作1的名称是 ;在过滤操作中要用到的玻璃仪器有烧杯、玻璃棒和 (填仪器名称);在加热蒸发过程中,当蒸发皿中 时,停止加热。
(2)上述除去泥沙后的澄清滤液中,还含有Ca2+、Mg2+等阳离子,要想知道该滤液是硬水还是软水,可加入 进行检验。
(3)海水提取出粗盐后的母液中,还含有较多的氯化镁。工业上从母液中提取氯化镁的过程如下:
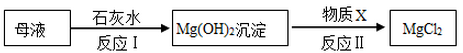
反应I的基本反应类型是 ;物质X是 (填名称)。
(4)工业上可用电解饱和NaCl溶液的方法制得烧碱、氢气和氯气,请写出该反应的化学方程式: 。
(5)从如图装置中选择并组装一套制取干燥氢气的装置,正确的连接顺序为 (用接口处字母填写);
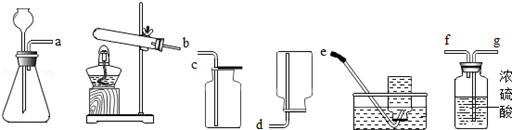
写出一个在实验室中用加热法制取氧气的化学方程式: 。
9编号:51203题型:解答题测试正确率:0.0%
如图所示为实验室中常见的气体制备、净化、收集和性质实验的部分仪器。试根据题目要求,回答下列问题:
(1)以石灰石和稀盐酸为原料制取并收集干燥、纯净的二氧化碳气体(提示:盐酸中挥发出的少量HCl气体可用饱和碳酸氢钠溶液吸收)。
①所选仪器的连接顺序为 (填写仪器序号字母)。
②生成二氧化碳时,所发生反应的化学方程式为 。
(2)为探究二氧化碳的性质,进行如下实验。
①将二氧化碳通入水中,用pH试纸粗略测定二氧化碳水溶液的酸碱性强弱,请简述测定的方法 。
②将二氧化碳通入氢氧化钠溶液中,并无明显反应现象,欲用化学方法证明CO2和NaOH溶液确实发生了化学反应,请从NaCl溶液、CaCl2溶液、稀硫酸三种试剂中选用一种试剂进行实验,简述实验操作及现象_______________________。
③将少量CO2气体通入盛有大量澄清Ca(OH)2溶液的大烧杯中,烧杯中溶液的质量与之前相比会 (填写下列各项序号)。
A.增大B.减少C.不变D.无法判断
(3)某班同学在做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质)。为了对废液进行处理,某同学做了如下实验:取废液缸上层清液20.0 g于烧杯中,逐滴滴入溶质质量分数为5.3%的碳酸钠溶液至过量,滴入碳酸钠溶液质量(g)与生成沉淀的质量(g)的变化关系如图所示。试计算实验过程中实际参加反应的碳酸钠溶液的质量。(相对原子质量:C—12O—16Na—23Ca—40)
10编号:51067题型:解答题测试正确率:50.21%
如图所示为实验室中常见的气体制备、净化、收集和性质实验的部分仪器。试根据题目要求,回答下列问题:

(1)以石灰石和稀盐酸为原料制取并收集干燥、纯净的二氧化碳气体(提示:盐酸中挥发出的少量HCl气体可用饱和碳酸氢钠溶液吸收)。
①所选仪器的连接顺序为 (填写仪器序号字母)。
②生成二氧化碳时,所发生反应的化学方程式为 。
(2)为探究二氧化碳的性质,进行如下实验。
①将二氧化碳通入水中,用pH试纸粗略测定二氧化碳水溶液的酸碱性强弱,请简述测定的方法 。
②将二氧化碳通入氢氧化钠溶液中,并无明显反应现象,欲用化学方法证明CO2和NaOH溶液确实发生了化学反应,请从NaCl溶液、CaCl2溶液、稀硫酸三种试剂中选用一种试剂进行实验,简述实验操作及现象 。
③将少量CO2气体通入盛有大量澄清Ca(OH)2溶液的大烧杯中,烧杯中溶液的质量与之前相比会 (填写下列各项序号)。
A.增大 B.减少 C.不变 D.无法判断
(3)某班同学在做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质)。为了对废液进行处理,某同学做了如下实验:取废液缸上层清液20.0g于烧杯中,逐滴滴入溶质质量分数为5.3%的碳酸钠溶液至过量,滴入碳酸钠溶液质量(g)与生成沉淀的质量(g)的变化关系如图所示。试计算实验过程中实际参加反应的碳酸钠溶液的质量。(相对原子质量:C—12O—16Na—23Ca—40)
