烧碱(NaOH)是一种重要的化工原料,广泛用于制肥皂、造纸等工业。请回答下列有关问题。
(1)在工业上通常用电解饱和NaCl溶液的方法制取烧碱,产物除烧碱外,还有H2和Cl2,请写出有关反应的化学方程式。
(2)烧碱放置在空气中会变质,请设计一个实验,在检验氢氧化钠变质的同时又能除去杂质(用化学方程式来表示)。
(3)在烧碱溶液和稀盐酸进行中和反应实验时,一般需要在烧碱溶液中滴加酚酞溶液,酚酞溶液的作用是什么?最后得到的溶液中溶质的构成微粒是 。
(4)下图是某同学用氢氧化钠固体和水配制50 g 5%的NaOH溶液的部分操作过程,该同学在称量氢氧化钠时,先在两个托盘上各放上一张质量相同的纸,然后把药品直接放在纸上称量。
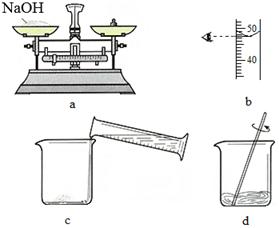
①a操作中有错误,正确的操作是 。
②下列操作中,会导致所配溶液中溶质的质量分数偏低的有 (填字母代号)。
A.a操作中将砝码放在左盘(1 g以下用游码)
B.b操作中平视量筒凹液面最低处读数为47.5 mL
C.c操作中烧杯用水洗涤后未干燥就使用
D.d操作中有少量溶液溅出(假设已搅拌均匀)
(5)73 g质量分数为20%的盐酸与一定质量的氢氧化钠溶液恰好完全反应,生成的氯化钠溶液中溶质的质量分数为13.52%。请计算氯化钠溶液的质量。
答案

知识点:综合应用题
(1)电解饱和氯化钠溶液能生成氢氧化钠、氢气和氯气,反应的化学方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
(2)固体NaOH易潮解,然后与空气中的CO2反应生成Na2CO3,要检验NaOH是否变质就是要检验是否存在Na2CO3,如果同时还想除去杂质,可以加入适量的Ca(OH)2溶液,化学方程式为Ca(OH)2+Na2CO3![]() 2NaOH+CaCO3↓。
2NaOH+CaCO3↓。
(3)烧碱溶液和稀盐酸发生中和反应时,没有明显现象,在烧碱溶液中滴加酚酞溶液,反应前溶液显红色,滴加稀盐酸过程中红色逐渐变浅,当烧碱和稀盐酸恰好完全反应时,溶液变为无色,所以酸碱指示剂的作用就是证明氢氧化钠与稀盐酸发生了反应,并指示二者何时恰好完全反应。氢氧化钠与稀盐酸恰好完全反应时,溶液中只有一种溶质NaCl,它是由Na+和Cl-构成的。
(4)①由于NaOH易潮解并且具有强腐蚀性,所以不能直接放在纸上称量,而应该放在小烧杯或表面皿上称量。
②A.配制50 g 5%的NaOH溶液需要NaOH固体的质量为50 g×5%=2.5 g,用天平称取NaOH固体时应该左物右码,如果把砝码放在左盘,则称取的NaOH固体的实际质量为2g-0.5 g=1.5 g,溶质质量偏小,导致所配溶液中溶质的质量分数偏低。
B.配制50 g 5%的NaOH溶液需要水的质量为50 g-2.5 g=47.5 g,即47.5 mL,用量筒量取时水时平视量筒凹液面的最低处,则读数正确,不会造成误差。
C.烧杯用水洗涤后未干燥就使用,则烧杯中的水也进入到了最终的溶液中,造成溶剂的质量偏大,导致所配溶液中溶质的质量分数偏低。
D.如果溶液已搅拌均匀,由于溶液具有均一稳定性,所以即使有少量溶液溅出也不会影响所配溶液中溶质的质量分数。
综上,会导致所配溶液中溶质的质量分数偏低的操作有AC。
(5)已知氯化钠溶液中溶质的质量分数为13.52%,要计算氯化钠溶液的质量,可以先求出氯化钠溶液中溶质的质量,NaCl的质量可以用参加反应的盐酸中溶质的质量,根据化学方程式NaOH+HCl![]() NaCl+H2O来求。
NaCl+H2O来求。
略








