金属材料在生产生活中有重要的作用。
(1)铁制品在一定条件下能生锈,疏松的铁锈不能阻碍里层的铁继续与 反应,因此铁制品可以进一步锈蚀。防止自行车链条生锈的合理措施是 。回收利用废旧金属制品的目的之一是 。
(2)某同学为了验证Fe、Zn、Cu三种金属的活动性顺序,设计了如下实验:
A.将锌片浸入稀硫酸溶液中;
B.将铜片浸入稀硫酸溶液中;
C.将锌片浸入硫酸亚铁溶液中。
该组实验能否完全证明三种金属的活动性顺序?若能,说明理由;若不能,请你补充一个实验达到目的。
(3)在Cu(NO3)2和Al(NO3)3的混合溶液中加入一定量的锌粉,充分反应后过滤。向滤出的固体上滴加稀硫酸时有气泡产生,则反应后所得溶液中含有的金属离子有 (用离子符号表示)。
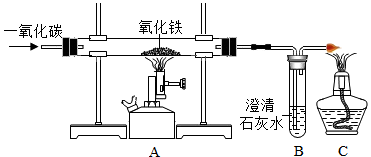
(4)工业上炼铁的原理是利用一氧化碳和氧化铁反应,某兴趣小组利用如图装置进行实验,请按要求回答:
①CO还原Fe2O3的化学方程式为 ;
②如果A装置中红棕色固体变成黑色,则B试管中观察的现象为 ,右边导气管口放置点燃的酒精灯的目的是 。
(5)用含杂质的铁10g(杂质不溶于水,也不参加反应)与100g稀硫酸恰好完全反应,滤去杂质,得到滤液质量为108.1g,则含杂质的铁中铁的质量分数。
答案
(1)氧气和水(5分);涂油(5分);节约有限的金属资源(5分)
(2)不能。补充实验:将铁片浸入稀硫酸溶液中或将铁片浸入硫酸铜溶液中。(15分,合理即可)
(3)Zn2+、Al3+(10分)
(4)①3CO+Fe2O3![]() 2Fe+3CO2(10分)
2Fe+3CO2(10分)
②石灰水变浑浊(10分)燃烧多余的CO,防止污染空气(10分)
(5)84%(30分)
知识点:综合应用题
本题以金属材料引入,综合金属防锈、金属活动性、工业炼铁以及金属和酸反应进行考查。
(1)铁生锈的条件是铁与氧气和水共同作用。防止铁生锈的措施是隔绝氧气和水。故防止自行车链条生锈的合理措施是在链条上面涂油,回收利用废旧金属制品的目的之一是节约有限的金属资源。
(2)三种金属的活动性顺序从强到弱为:Zn>Fe>Cu。由实验A可证明:Zn>H;由实验B可证明:H>Cu;则实验A、B可得出Zn>Cu。由实验C可证明:Zn>Fe;综合以上三个实验可得到:Zn>Fe,Zn>Cu,但是并不能验证Fe>Cu,故该组实验不能完全证明三种金属的活动性顺序。需要补充一个实验证明Fe>Cu,如:将铁片浸入稀硫酸溶液中或将铁片浸入硫酸铜溶液中,合理即可。
(3)三种金属的活动性顺序从强到弱为:Al>Zn>Cu。由题意知,向滤出的固体上滴加稀硫酸时有气泡产生,说明锌粉过量,则混合溶液中的硝酸铜完全反应,但硝酸铝不参加反应,故反应后的溶液中含有的金属离子有Zn2+和Al3+。
(4)①CO还原Fe2O3的化学方程式为3CO+Fe2O3![]() 2Fe+3CO2。
2Fe+3CO2。
②如果A装置中红棕色固体变成黑色,说明Fe2O3被还原成Fe,炼铁反应发生,生成的CO2使B试管中的澄清石灰水变浑浊。由于尾气中含有CO,会污染空气,故右边导气管口放置点燃的酒精灯的目的是燃烧多余的CO,防止污染空气。
(5)含杂质的铁中加入稀硫酸,其中铁被消耗,发生的化学方程式为:Fe+H2SO4=FeSO4+H2↑,生成的氢气逸散出去,设纯铁的质量为x,根据质量守恒定律可以求出生成氢气的质量为:x+100g-108.1g=x-8.1g,根据氢气的质量和纯铁的质量可以利用化学方程式进行求解,求出纯铁的质量,再比上总质量就可以求出质量分数。计算过程如下:

略








