已知金属钠和水能发生下列反应:2Na+2H2O=2NaOH+H2↑。现取金属钠4.6g投入到100g水中,充分反应后,冷却到室温(20℃),得到一种不饱和溶液,向所得溶液中逐滴滴入MgSO4溶液,实验测得溶液的总质量与滴入MgSO4溶液的质量关系曲线如下图所示:
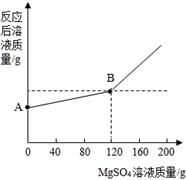
下列说法正确的是( )
- A.金属钠和水充分反应后,生成H2的质量为0.1g
- B.图中A点的纵坐标表示的溶液的质量是104.6g
- C.A—B段发生的化学反应为2NaOH+MgSO4=Mg(OH)2↓+Na2SO4
- D.当滴入120g MgSO4溶液时,所得溶液中溶质的质量分数为6%
答案
正确答案:C
知识点:化学方程式的计算
A.由于所得溶液为不饱和溶液,因此Na全部和水反应,生成H2的质量可根据
2Na+2H2O=2NaOH+H2↑求出。
B.分析题意可知,图中A点的纵坐标表示的溶液的质量就是金属钠4.6g投入到
100g水中,充分反应后,得到溶液的质量,因此,A点的纵坐标表示的溶液的
质量=4.6 g金属钠+100g水-0.2 g H2=104.4g,B错误;
C.向所得溶液中逐滴滴入MgSO4溶液,MgSO4溶液先和NaOH反应生成Mg(OH)2
沉淀,由于有沉淀的生成,反应后溶液质量增加比较缓慢,当将NaOH全部
消耗完后,滴入MgSO4溶液不再发生反应,溶液质量增加的量即为滴入MgSO4
溶液的质量,因此A—B段发生的化学反应为
2NaOH+MgSO4=Mg(OH)2↓+Na2SO4,C正确;
D.当滴入MgSO4溶液的质量为120g时,恰好将NaOH消耗完,故溶液中的溶质
全部为Na2SO4,根据方程式MgSO4+2NaOH=Na2SO4+Mg(OH)2↓可知Na2SO4的质量
根据NaOH的质量求出,而NaOH的质量可根据2Na+2H2O=2NaOH+H2↑中Na的质量
求出,而溶液的质量=金属钠4.6g+100 g水+滴入的120gMgSO4溶液-生成沉淀
Mg(OH)2的质量-生成的气体H2质量。
由上面的分析可知,设生成NaOH的质量为x,生成H2的质量为y,则
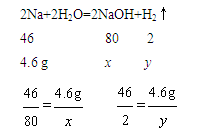
解得:x=8gy=0.2 g
故A错误。
设最终生成Na2SO4的质量为z,生成Mg(OH)2的质量为w,则
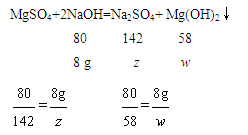
解得:z=14.2g,w=5.8g
反应后溶液的总质量为:4.6 g+100 g+120g-5.8 g-0.2 g=218.6 g
Na2SO4溶液中溶质的质量分数为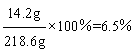 。
。
故D错误。
略








