甲、乙、丙三位同学分别取锌粉和铜粉的均匀混合物与某稀硫酸反应,所得数据如下表所示:
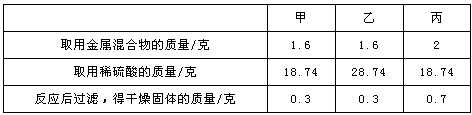
下列说法错误的是( )
- A.所取混合物与稀硫酸恰好完全反应的是甲同学的实验
- B.甲、乙两同学所取混合物中锌的质量为1.3 g
- C.丙同学所取混合物中铜的质量为0.7 g
- D.甲、乙、丙三位同学的实验中生成气体的质量相同
答案
正确答案:C
知识点:化学方程式的计算
A.根据金属的活动性顺序:锌>氢>铜,锌能与稀硫酸反应生成硫酸锌同时放出氢气,而铜不能与稀硫酸反应。因此,当把金属混合物放入足量稀硫酸中充分反应时,剩余固体为铜。甲和乙作比较可以看出,增加酸的质量,反应后固体质量不再减少,说明甲中锌已完全反应;甲和丙作比较可以看出,增加金属混合物的质量(2 g-1.6 g=0.4g),反应后固体质量的增加量(0.7 g-0.3 g=0.4g)与之相同,说明增加的金属混合物没有和酸反应,丙中酸不足,即18.74 g硫酸参与反应且消耗锌的质量为2 g-0.7 g=1.3 g,由此推出甲恰好完全反应,A正确;
B.由A中分析可知,18.74 g硫酸和1.3 g锌恰好完全反应,因此1.6 g金属混合物中含有1.3 g锌,B正确;
C.由A中分析可知,丙中酸不足,金属混合物过量,因此反应后固体质量0.7g中除了铜的质量还有一部分锌的质量,C错误;
D.由A中分析可知,甲、乙、丙三位同学的实验中均为1.3 g锌和18.74 g硫酸反应,所以生成氢气的质量相同,D正确。
故选C。
略








