一定质量的锌、铁分别和等量的盐酸反应,产生的氢气质量与时间的关系如图所示,下列说法不正确的是( )
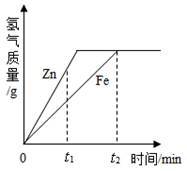
- A.t1时,锌产生氢气的质量比铁大
- B.t1时,锌产生氢气的速率比铁大
- C.t2时,参加反应锌的质量与铁相同
- D.t2时,锌、铁消耗的盐酸质量相同
答案
正确答案:C
知识点:金属与酸反应
A.根据图象可知,纵坐标代表的是氢气质量,t1时,锌比铁对应的纵坐标大,所以锌产生氢气的质量比铁大,A正确。
B.产生氢气的速率和金属的活动性有关,金属活动性越强,与酸反应的速率越大,即产生氢气的速率越大。表现在氢气质量~时间的图象上:金属活动性越强,斜率越大。根据图象可以看出,锌的金属活动性强于铁,所以锌产生氢气的速率比铁大,B正确。
C.根据图象可知,t2时,锌、铁产生的氢气质量相等。因为不同金属与酸反应产生氢气的质量和金属的相对原子质量有关,因为金属的相对原子质量不同,则产生的氢气质量相等的情况下,参加反应的金属质量肯定不同,C错误。
D.根据图象可知,t2时,锌、铁产生的氢气质量相等。因为氢气全部是由参与反应的盐酸中的氢转化得到,所以锌、铁消耗的盐酸质量相同,D正确。
故选C。
略








