甲酸(HCOOH)通常是一种无色易挥发的液体,它在浓硫酸作用下易分解,反应的化学方程式为HCOOH CO↑+H2O。某课外活动小组的同学欲用该反应来制取纯净的CO还原氧化铜粉末,并检验反应后的生成物,现有下列仪器或装置供选择:
CO↑+H2O。某课外活动小组的同学欲用该反应来制取纯净的CO还原氧化铜粉末,并检验反应后的生成物,现有下列仪器或装置供选择:
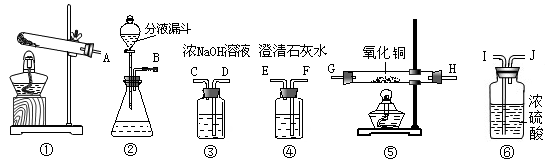
(1)该小组同学另查阅资料:NaOH溶液可以吸收甲酸气体。则各仪器的接口连接顺序为 (填字母)。
(2)从开始加热到实验结束,装置⑤中玻璃管内的现象为 ,发生反应的化学方程式为 。
(3)上述实验还存在一个明显的不足之处,请指出并提出改进方案:
。
答案
(1)BDCIJGHFE。
(2)固体粉末由黑色变为红色;CuO+CO![]() Cu+CO2。
Cu+CO2。
(3)没有进行尾气处理,需将尾气点燃或收集。
知识点:还原性物质相关实验
分析题意,甲酸分解产生的CO进入到装置⑤,与CuO发生反应:CuO+CO![]() Cu+CO2,生成的CO2用澄清石灰水检验。甲酸的分解应在装置②中进行,进入到装置⑤之前的CO中可能会混有挥发出的甲酸气体和水蒸气,可分别用NaOH溶液和浓硫酸除去。
Cu+CO2,生成的CO2用澄清石灰水检验。甲酸的分解应在装置②中进行,进入到装置⑤之前的CO中可能会混有挥发出的甲酸气体和水蒸气,可分别用NaOH溶液和浓硫酸除去。
(1)根据分析,各仪器的接口连接顺序为BDCIJGHFE。
(2)玻璃管内发生的反应为CuO+CO![]() Cu+CO2,其现象为固体粉末由黑色变为红色。
Cu+CO2,其现象为固体粉末由黑色变为红色。
(3)CO有毒,直接排放会引起空气污染,上述实验明显的不足之处在于没有进行尾气处理,可将尾气点燃或收集。
略








