金属材料在生产生活中有重要的作用。
(1)建筑物需要用大量的钢铁,钢和生铁的主要成分都是铁,工业上炼铁反应的化学方程式为 。
(2)某同学为了验证Fe、Zn、Cu三种金属的活动性顺序,设计了如下实验:
A.将锌片浸入稀硫酸溶液中;
B.将铜片浸入稀硫酸溶液中;
C.将锌片浸入硫酸亚铁溶液中。
该组实验能否完全证明三种金属的活动性顺序?若能,说明理由;若不能,请你补充一个实验达到目的。
(3)如图为实验室制取、净化、收集气体的装置。
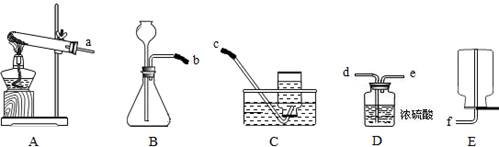
①用A装置制取氧气的化学方程式为 。
②实验室制取氢气可用锌粒与稀硫酸在常温下反应,反应的化学方程式为
,请从上面仪器中选择适当的仪器组成一套制取干燥氢气的装置,各仪器从左到右的接口顺序是 (填各仪器接口处的小写字母)。
(4)黄铜是由铜和锌组成的合金,为了测定黄铜样品的组成,小华同学将10g黄铜样品放入盛有50g稀硫酸的烧杯中,恰好完全反应后烧杯中物质的总质量为59.8g。
求:①黄铜样品中锌的质量分数。
②所用稀硫酸溶液的溶质质量分数。
答案

知识点:综合应用题
本题以金属材料引入,综合金属活动性、实验室制取氢气以及金属和酸的反应进行考查。
(1)工业炼铁的化学方程式为:Fe2O3+3CO![]() 2Fe+3CO2。
2Fe+3CO2。
(2)三种金属的活动性顺序从强到弱为:Zn>Fe>Cu。由实验A可证明:Zn>H;由实验B可证明:H>Cu;则实验A、B可得出Zn>Cu。由实验C可证明:Zn>Fe;综合以上三个实验可得到:Zn>Fe,Zn>Cu,但是并不能验证Fe>Cu。
故该组实验不能完全证明三种金属的活动性顺序。需要补充一个实验证明出Fe>Cu,如:将铁片浸入稀硫酸溶液中或将铁片浸入硫酸铜溶液中,合理即可。
(3)①A装置属于固体加热型装置,用其制取氧气的化学方程式为:2KClO3 2KCl+3O2↑(若选用分解KMnO4,在试管口需有一团棉花,本题中没有)。
2KCl+3O2↑(若选用分解KMnO4,在试管口需有一团棉花,本题中没有)。
②用锌粒与稀硫酸在常温下制取氢气的化学方程式为:Zn+H2SO4=ZnSO4+H2↑;欲制取干燥的氢气,需对生成的氢气进行干燥(干燥时需注意,应从长管进入),且用向下排空气法进行收集,故各仪器从左到右的接口顺序是b-d-e-f。
(4)黄铜样品中加入稀硫酸,其中锌被消耗,发生反应的化学方程式为:
Zn+H2SO4=ZnSO4+H2↑,生成的氢气逸散出去,导致烧杯中物质的总质量(59.8g)
小于加进去的黄铜样品和稀硫酸的总质量(10g+50 g=60 g),即减小的质量
(60g-59.8 g=0.2 g)为生成氢气的质量。
①要求黄铜样品中锌的质量分数,需知道其中锌的质量,因为氢气的质量已知,可以根据化学方程式进行求解。
②要求所用的稀硫酸溶液的溶质质量分数,需求出对应的溶质、溶液的质量。根据题意,溶液的质量为50g,稀硫酸中的溶质(硫酸)恰好完全反应,溶质质量可以根据化学方程式进行求解。
略








