一定量的木炭在盛有氧气和氮气混合气体的密闭容器中燃烧,有关分析正确的是( )
- A.反应前后混合气体中氮气的质量分数不变
- B.反应后气体混合物的组成有3种情况
- C.若反应后是3种气体的混合物,则其中C、O元素的质量比一定小于12:16
- D.若反应后气体中有氧气,则容器中C、O元素的质量比大于12:32
答案
正确答案:C
一定量的木炭在盛有氧气和氮气混合气体的密闭容器中燃烧,发生的反应可能有C+ O2![]() CO2、2C+ O2
CO2、2C+ O2![]() 2CO。
2CO。
A.木炭燃烧生成了CO或CO2,反应前后混合气体的质量发生改变,而氮气的质量不变,因此氮气的质量分数发生改变,A错误。
B.由于氮气不参加反应,因此反应后肯定含有氮气,若氧气有剩余,则木炭全部燃烧生成CO2,反应后混合气体为N2、O2、CO2;若氧气没有剩余,则木炭燃烧可能生成CO或CO2,反应后混合气体的组成可能为N2、CO,N2、CO2或N2、CO、CO2。因此反应后混合气体的组成有四种情况,B错误。
C.若反应后是三种气体的混合物,则可能为N2、O2、CO2或N2、CO、CO2,N2、O2中C、O元素的质量比均为0,CO中C、O元素的质量比为12:16,CO2中C、O元素的质量比为12:32。
①若为N2、O2、CO2的混合气体,将各数据标在数轴上:
 ,则混合气体中C、O元素的质量比一定小于12:32。
,则混合气体中C、O元素的质量比一定小于12:32。
②若为N2、CO、CO2的混合气体,将各数据标在数轴上:
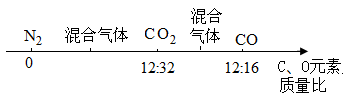 ,则混合气体中C、O元素的质量比一定小于12:16。
,则混合气体中C、O元素的质量比一定小于12:16。
综上,无论混合气体是N2、O2、CO2或N2、CO、CO2,其中C、O元素的质量比一定小于12:16,C正确;
D.若反应后气体中有O2,则反应后气体混合物只能是N2、O2、CO2,根据上述①中分析可知,混合气体中C、O元素的质量比一定小于12:32,D错误。
故选C。
略







