现有一密闭容器,充入4g甲烷(CH4)和20g氧气,引燃后发生的反应为CH4+2O2 CO2+2H2O,试计算:
CO2+2H2O,试计算:
(相对原子质量:H-1,C-12,O-16)
(1)生成的水的质量为____g。
(2)反应后冷却至室温,密闭容器中剩余气体的质量为____g。
答案
9,15
知识点:化学方程式的计算
(1)要求生成的水的质量,需知道参加反应的甲烷或氧气的质量。
由化学方程式CH4+2O2![]() CO2+2H2O可知,参加反应的甲烷和氧气的质量比为16:(2×32)=1:4,则4g甲烷需要消耗氧气的质量为16g,所以题中给出的氧气有剩余,需根据完全参与反应的甲烷的质量求生成的水的质量。
CO2+2H2O可知,参加反应的甲烷和氧气的质量比为16:(2×32)=1:4,则4g甲烷需要消耗氧气的质量为16g,所以题中给出的氧气有剩余,需根据完全参与反应的甲烷的质量求生成的水的质量。
设4 g甲烷与氧气反应生成水的质量为x。则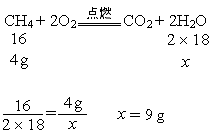
(2)思路一:反应后冷却至室温,除生成的水外,其他物质均为气体,用反应后的物质总质量减去生成水的质量即为密闭容器中剩余气体的质量。根据密闭容器中任一时刻物质总质量守恒可知,反应后的物质总质量为4g+20g=24g,所以反应后冷却至室温,剩余气体的质量为24g-9g=15g。
思路二:反应后冷却至室温,剩余的气体有生成的CO2和剩余的4g O2,可根据化学方程式求出生成的CO2的质量,同学们可自己进行计算。
略







