某实验室的废水中含有大量AgNO3、Zn(NO3)2和Fe(NO3)2,课外小组同学欲从该废液中回收银,并得到副产品硫酸亚铁晶体。实验方案如下:
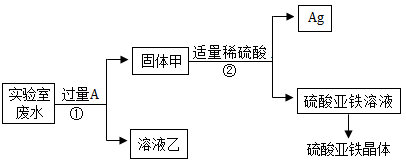
操作①的名称是____,固体甲中含有的物质是____、____(填物质名称),溶液乙中所含溶质为____、____(填物质名称)。
答案
过滤,银,铁,硝酸锌,硝酸亚铁
知识点:金属活动性的应用
废液中回收金属和金属化合物解题步骤:
根据回收目的,结合反应后滤渣、滤液成分,分析各环节的物质组成和化学反应。
题目中涉及到的金属有Ag、Zn、Fe、A,活动性顺序为Zn>Fe>Ag,其中加入的金属为A。
加入过量的A后得到固体甲,因此固体甲中一定含有金属A,固体甲加入稀硫酸后过滤得到Ag和FeSO4,因此固体甲中一定含有Ag,故固体甲中一定含有Ag和金属A。加入稀硫酸后固体中只剩余Ag,说明金属A与稀硫酸发生了反应,由于反应后的溶液中只有FeSO4,故金属A为Fe。
向AgNO3、Zn(NO3)2和Fe(NO3)2混合溶液中加入过量的Fe,Fe只能将AgNO3中的Ag全部置换出来,而Fe反应后生成Fe(NO3)2,因此溶液乙中含有Zn(NO3)2和Fe(NO3)2。
略








