现有40.6g氧化钙和碳酸钙的固体混合物,将其高温煅烧至碳酸钙完全分解(化学方程式为CaCO3 CaO+CO2↑),称得煅烧后剩余固体质量比原混合物减少13.2 g,则原固体混合物中氧化钙的质量为( )
CaO+CO2↑),称得煅烧后剩余固体质量比原混合物减少13.2 g,则原固体混合物中氧化钙的质量为( )
(相对原子质量:C-12,O-16,Ca-40)
- A.5.6 g
- B.10.6 g
- C.16.8 g
- D.30 g
答案
正确答案:B
知识点:化学方程式的计算
要求原固体混合物中氧化钙的质量,需要计算原固体混合物中碳酸钙的质量。根据题意碳酸钙完全分解,所以参与反应的碳酸钙即为原固体混合物中碳酸钙的质量。
反应过程中固体减少的质量(13.2 g)为生成CO2的质量,根据生成物求反应物的质量。
设参与反应的碳酸钙的质量为x。则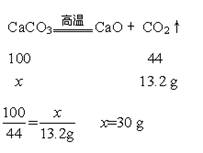
原固体混合物的中氧化钙的质量为40.6g-30 g=10.6 g。
故选B。
略







