某校科研小组为检测某生锈的镁带(镁锈的主要成分为MgO)中镁元素的质量分数,取该样品3.2 g,向其中滴加19.6%稀硫酸50 g恰好完全反应,收集氢气0.1 g,则该样品中镁元素的质量分数为( )
- A.37.5%
- B.62.5%
- C.75%
- D.25%
答案
正确答案:C
知识点:化学反应方程式的计算
MgO和Mg均能与H2SO4反应,发生反应的方程式为:Mg + H2SO4=MgSO4+ H2↑、
MgO + H2SO4=MgSO4 + H2O。题目中给出了H2的质量,根据方程式可求出镁带
中Mg的质量,继而可求出MgO的质量,根据Mg和MgO的质量,可求出镁元素的
质量,从而求出Mg的质量分数。
设样品中Mg的质量是x,则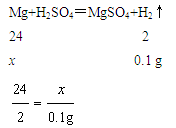
解得x=1.2g
MgO的质量=3.2 g-1.2 g=2 g,其中含Mg:![]()
Mg的总质量=1.2 g+1.2 g=2.4 g,该样品中镁元素的质量分数为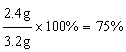 。
。
故选C。
略







