目前世界上60%的镁是从海水中提取的,其主要步骤如下。下列说法不正确的是( )
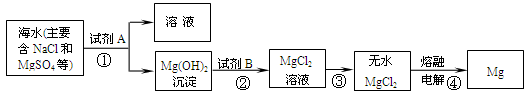
- A.提取Mg的过程中,试剂A可能选用NaOH溶液,试剂B选用盐酸
- B.步骤①得到的溶液中还含有CaCl2、Na2SO4等杂质,可依次加入过量的Na2CO3和BaCl2溶液,过滤,再向滤液中加入适量盐酸从而得到杂质较少的NaCl溶液
- C.步骤③进行的操作是蒸发结晶、灼烧
- D.步骤④发生反应的方程式为MgCl2
 Mg+Cl2↑
Mg+Cl2↑
答案
正确答案:B
知识点:粗盐提纯
A.步骤①反应后生成的物质为Mg(OH)2,故试剂A为可溶性碱,可提供OH-,可能为NaOH,发生反应2NaOH+ MgCl2 = Mg(OH)2↓+2NaCl;步骤②得到MgCl2,则试剂B肯定为盐酸,发生反应Mg(OH)2+ 2HCl = MgCl2+ 2H2O,A正确。
B.要除去CaCl2、Na2SO4等杂质,可将其通过生成沉淀而除去,Ca2+可以和CO32-生成沉淀,SO42-可以和Ba2+生成沉淀,为避免引入其他杂质离子,故选用Na2CO3和BaCl2,若要得到杂质较少的NaCl溶液,需将加入的过量的Na2CO3和BaCl2溶液除去,Na2CO3可以将过量的BaCl2除去,而Na2CO3可以通过盐酸除去,故加入的顺序为BaCl2和Na2CO3溶液,反之,则
BaCl2将难以除去,B错误。
C.由MgCl2溶液得到无水MgCl2的方法为蒸发结晶、灼烧,C正确。D.由无水MgCl2得到Mg,方程式为MgCl2![]() Mg+Cl2↑,D正确。
Mg+Cl2↑,D正确。
故选B。
略








