某化学兴趣小组的同学往氢氧化钠溶液中滴加稀硫酸时,没有看到明显现象。
(1)提出问题
氢氧化钠与硫酸是否发生了化学反应?
(2)查阅资料
酸与碱发生中和反应会放出热量。
(3)实验设计
甲、乙、丙、丁四位同学分别设计了如下实验方案,请你帮他们完成实验报告。
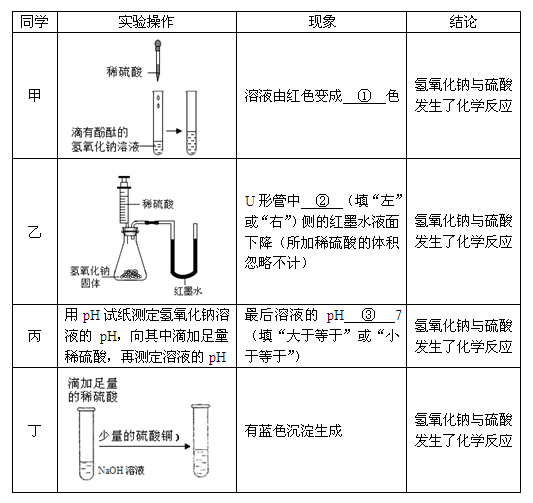
表中空白处需要填入的内容是①____;②____;③____。
(4)评价反思
你认为实验方案不合理的同学是____和____。
(5)拓展延伸
另有一位同学向自己配制的氢氧化钠溶液中滴加酚酞试液时,溶液变红色,可是红色立即消失了,出现此意外情况的原因是____(填以下序号)。
A.所用的酚酞试液是变质的
B.所用的氢氧化钠溶液浓度太小
C.氢氧化钠溶液吸收了空气中二氧化碳
答案
无,左,小于等于,乙,丁,B
知识点:酸碱中和反应的发生
(3)甲:酚酞试液遇到碱性溶液变红,遇到中性溶液或酸性溶液不变色,氢氧化钠和盐酸反应的生成物是氯化钠和水,氯化钠溶液显中性。所以氢氧化钠中滴加盐酸时,当把氢氧化钠反应完了,溶液就会变为无色。
乙:氢氧化钠固体溶于水会放出大量的热,氢氧化钠与盐酸反应也能放出热量,会导致瓶内温度升高,压强增大,所以U形玻璃管中液面左侧下降右侧上升。
丙:加入足量稀硫酸可以将氢氧化钠全部消耗完,至于硫酸是否过量则不确定,故可能显酸性或中性,pH小于等于7。
(4)乙:氢氧化钠固体溶于水会放出大量的热,氢氧化钠与盐酸反应也能放出热量,故不能根据此现象判断氢氧化钠和硫酸是否发生了反应,故乙的方案不合理。
丁:滴加足量稀硫酸可将氢氧化钠全部反应完,生成硫酸钠和水,故滴加足量稀硫酸后的溶液是硫酸钠溶液或者是硫酸钠溶液和稀硫酸的混合物,因为没有氢氧化钠的存在,因此滴加少量的硫酸铜后不会产生蓝色沉淀,故丁的方案不合理。
(5)由于溶液变红色了,说明酚酞试液没有变质,故A错;氢氧化钠溶液吸收了空气中二氧化碳生成碳酸钠,也是显碱性,也能使酚酞试液变红,故C错误;如果氢氧化钠溶液浓度太小会造成,开始滴加酚酞变红,红色立即消失,故B正确。
略








