某合金由两种金属元素组成,取该合金60 g投入足量稀硫酸中,反应完全后,测得生成氢气2 g,则合金的组成可能是( )
①Fe与Zn ②Mg与Cu ③Mg与Al ④Al与Fe
- A.①②
- B.①④
- C.②③
- D.③④
答案
正确答案:A
知识点:金属与酸反应
求合金的组成,可用平均值法进行解答。
设合金中两种金属的平均相对原子质量为![]() ,且两种金属与稀硫酸反应后,在生成物中均为+2价。
,且两种金属与稀硫酸反应后,在生成物中均为+2价。
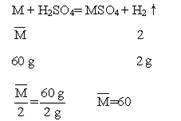
即两种金属的相对原子质量一个要大于60,一个要小于60;或者一种金属要比等质量的金属M产生氢气的质量大,另一种金属要比等质量的金属M产生氢气的质量小。
①Fe与Zn的相对原子质量分别为56、65,Fe与Zn满足题中合金的组成。
②根据等质量的金属完全参与反应,相对原子质量越小,产生的氢气质量越大可知,Mg要比等质量的金属M产生氢气的质量大;Cu不能与稀硫酸发生反应,可理解为产生的氢气质量为0,即Cu要比等质量的金属M产生氢气的质量小。Mg与Cu满足题中合金的组成。
③Mg与Al均比等质量的金属M产生氢气的质量大,不满足题中合金的组成。
④Al与Fe均比等质量的金属M产生氢气的质量大,不满足题中合金的组成。
故选A。
略







