生活中常见物质的性质、制法等是化学研究的重要内容。
(1)复分解反应发生后,生成物肯定不会是 (填“单质”或“化合物”)。
(2)盐酸与氢氧化钠溶液反应时溶液pH的变化如图所示。下列说法正确的是 。
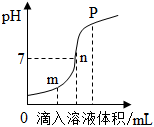
a.m点所示溶液为碱性
b.n点所示溶液中加紫色石蕊溶液显红色
c.p点所示溶液中的溶质为NaCl和NaOH
d.该图所对应操作是将盐酸滴入氢氧化钠溶液中
(3)浓硫酸和浓盐酸敞口放置均会变稀,这是为什么?
(4)下图装置可做一氧化碳还原氧化铁的实验,并检验生成的气体产物。

①B装置玻璃管里可观察到的现象是 。
②C装置中反应的化学方程式为 。
③实验结束后,若要确定A装置的溶液中溶质的成分,请设计合理的实验方案,简要写出实验步骤、现象和结论。(提示:Na2CO3溶液呈碱性)
(5)工业上可利用“铝热反应”焊接钢轨、冶炼难熔金属等,其原理是在高温下用铝将某些金属从其氧化物中置换出来。若用铝与四氧化三铁反应来制取25.2kg铁,理论上需要消耗铝的质量是多少?
答案
(1)单质(2分)
(2)c(2分)
(3)浓硫酸有吸水性,溶剂会增多;浓盐酸有挥发性,溶质会减少。(2分)
(4)①固体粉末由红色逐渐变为黑色(2分)
②Ca(OH)2+CO2![]() CaCO3↓+H2O(2分)
CaCO3↓+H2O(2分)
③取少量A装置中的![]() 溶液,加入足量的BaCl2溶液(或CaCl2溶液),有白色沉淀生成,说明溶质中含有Na2CO3;静置,取上层清液,向其中滴几滴无色酚酞溶液,若溶液变红色,则溶质中还含有NaOH,若不变红,则溶质中只有Na2CO3。(4分)
溶液,加入足量的BaCl2溶液(或CaCl2溶液),有白色沉淀生成,说明溶质中含有Na2CO3;静置,取上层清液,向其中滴几滴无色酚酞溶液,若溶液变红色,则溶质中还含有NaOH,若不变红,则溶质中只有Na2CO3。(4分)
(5)
知识点:中和反应 工业炼铁 常见的酸 化学方程式的计算 复分解反应发生的条件 碱的变质
(1)复分解反应是两种化合物互相交换成分,生成另外两种化合物的反应,生成物不可能是单质。
(2)m点溶液的pH小于7,显酸性;n点溶液的pH等于7,呈中性,紫色石蕊溶液在中性溶液中显紫色;氢氧化钠溶液和盐酸反应生成氯化钠和水,p点溶液的pH大于7,说明氢氧化钠过量,溶液中的溶质是氯化钠和氢氧化钠;实验过程中,开始时溶液显酸性,随着滴入溶液体积的增加,溶液逐渐变为碱性,所以对应的操作应为将氢氧化钠溶液滴入盐酸中。
(3)浓硫酸具有吸水性,放置在空气中会吸收水蒸气,溶剂质量变大,溶质质量分数变小;浓盐酸具有挥发性,溶质质量逐渐减小,导致溶液中溶质的质量分数逐渐变小。
(4)①一氧化碳还原氧化铁的现象为:固体粉末由红色逐渐变为黑色;
②二氧化碳和澄清石灰水反应的化学方程式为:CO2+Ca(OH)2![]() CaCO3↓+H2O;
CaCO3↓+H2O;
③二氧化碳和氢氧化钠溶液反应生成碳酸钠和水,溶液中一定含有碳酸钠,可能含有氢氧化钠,这是一个典型的碱的变质问题。
(5)首先根据题意写出化学方程式,然后结合化学方程式,根据生成铁的质量求出理论上需要消耗金属铝的质量。
略









